Desmosin протеиногенная аминокислота. Вместе с другими аминокислотами он образует клетчатку и структурный белок эластин. При мутации в гене ELN нарушается структура эластина.
Что такое десмозин?
Аминокислоты - важная часть человеческого организма. Это класс органических соединений, которые образованы по крайней мере из одной карбоксильной группы и одной аминогруппы. Следовательно, аминокислоты представляют собой как карбоновые кислоты, так и амины.
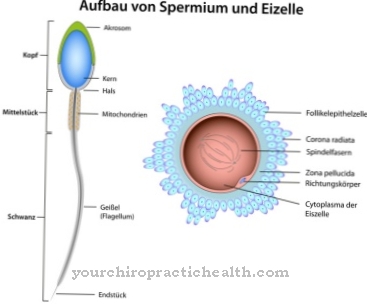
В зависимости от их положения по отношению к карбоксильной группе аминокислоты могут быть отнесены к разным группам. Аминокислоты с концевой карбоксильной группой называются геминальными или α и считаются среди α-аминокислот. Эти аминокислоты являются элементами белков. В организме человека более 20 протеиногенных аминокислот и 400 непротеиногенных аминокислот. D-аминокислоты представляют собой особую группу. Одной из более чем 20 протеиногенных аминокислот является десмозин, который вместе с аналогичным изодесмозином образует волокнистый белок эластин.
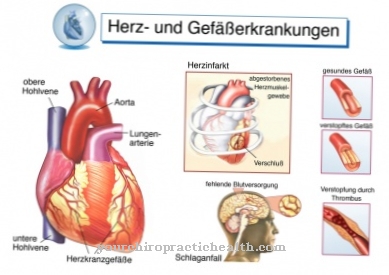
Эластин и его растворимый предшественник тропоэластин относятся к структурным белкам и способствуют формированию и сохранению анатомических структур. Эластин играет особую роль в способности к растяжению крупных кровеносных сосудов, например аорты.
Функция, эффект и задачи
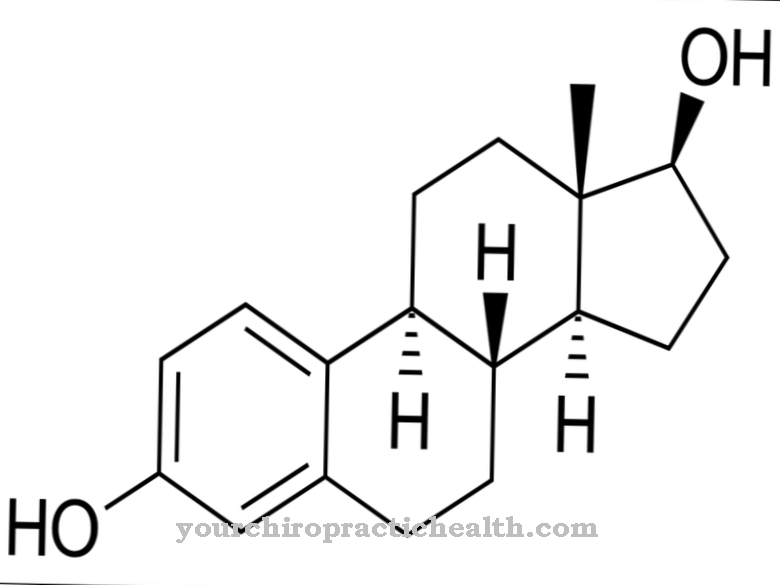
Десмозин формально является четырехкратной аминокислотой. В центре - кольцо с пиридинием. Пиридин представляет собой химическое соединение с эмпирической формулой C5H5N, которое относится к гетероциклическим исходным системам и образует простейший азин в форме шестичленного кольца с одним атомом азота и пятью атомами углерода.
Благодаря своему центральному пиридиниевому кольцу десмозин может объединять отдельные белковые нити в волокнистый белок эластин. Состав эластина аналогичен составу коллагена. Однако вместо гидроксилизина эластин содержит значительную долю валина. Остатки лизина окисляются до аллизина под действием фермента лизилоксидазы. Три аллизина и один лизин, в свою очередь, образуют десмозин в форме кольца. Эта форма играет важную роль в эластичности всей молекулы эластина.
В качестве белковой сети эластин состоит из звеньев, связанных с десмозином, и эластично растягивается. Легкие, а также кожа и кровеносные сосуды зависят от эластина и входящего в его состав десмозина, так как только так они получают значительную эластичность. Десмозин флуоресцирует синим цветом под УФ-светом и придает эластину желтый цвет, его нерастворимость в воде, термостойкость и устойчивость к щелочам и протеазам.
Образование, возникновение, свойства и оптимальные значения
Образование десмозина также известно как биосинтез десмозина. Во время этого биосинтеза концевые аминогруппы L-лизиновых единиц превращаются в ω-альдегиды ферментом лизилоксидазой посредством окисления.
Лизилоксидаза представляет собой протеин-лизин-6-оксидазу и, таким образом, соответствует ферменту, который находится во внеклеточном пространстве соединительной ткани. При сшивании эластина и коллагена он служит катализатором и механическим стабилизатором белков. Во время биосинтеза десмозина лизилоксидаза превращает лизин в аллизин. Этот процесс происходит во внеклеточном матриксе и стабилизирует перекрестные связи между коллагеном и эластином.С химической точки зрения реакция соответствует окислительному дезаминированию с образованием альдегида. Аллизин образует либо аллизинальдол, либо десмозин с альдегидными остатками соседних молекул тропеластина посредством альдольной конденсации.
Оставшийся лизин образует основание Шиффа через свою аминогруппу и создает изодесмозин. Помимо кровеносных сосудов, легких и кожи, все микрофибриллы, в частности, несут десмозин. Это мельчайшие волокна коллагеновой, ретикулярной и эластической ткани.
Заболевания и расстройства
Образование эластина из таких компонентов, как десмозин, нарушается при различных заболеваниях. Эти заболевания в первую очередь включают мутации в гене ELN. Наиболее важными из них являются дерматохалазис, синдром Вильямса-Бёрена и подклапанный врожденный стеноз аорты. Дерматохалазис - это группа изменений соединительной ткани с семейным накоплением.
Для этой группы характерна дряблая, менее эластичная и морщинистая кожа на различных участках тела. Ген ELN кодирует эластин и может вызывать такие симптомы в результате мутации. Синдром Вильямса-Бёрена встречается довольно редко по сравнению с этим, поражая только одного из 20 000 новорожденных. Заболевание вызвано дефектом седьмой хромосомы. Локус гена - 7q11.23. Из-за дефекта на этом этапе у пострадавшего отсутствует ген эластина и соседние гены. Делеция гена эластина вызывает дисморфизм лица и нарушения строения внутренних органов. Могут возникнуть пороки сердца, такие как надклапанный стеноз аорты, и пороки развития почек, такие как подковообразная почка или стеноз почечных сосудов. Кроме того, часто бывает когнитивная недостаточность.
Умственные способности пострадавших ниже среднего. Несмотря на словесную выразительность, они в основном формируют предложения с небольшим содержанием. Они начинают читать в очень раннем возрасте, что часто переоценивает их умственные способности. Помимо гиперлексии, их абсолютный слух часто приводит к завышению оценок. Как форма мутации эластина, подклапанный врожденный стеноз аорты, в свою очередь, соответствует пороку сердца, связанному с сужением основной артерии. Надклапанный стеноз лежит над аортальным клапаном в начале аорты.
Эта форма порока сердца часто характеризуется сужениями в форме песочных часов, которые расположены выше выхода коронарных сосудов. Также может быть сужена восходящая часть аорты. Эта форма стеноза аорты особенно часто возникает в контексте только что обсужденного синдрома Вильямса-Бёрена. Этот порок сердца уже наблюдается независимо от заболевания. В этом случае, однако, это не обязательно должно быть связано с мутацией в гене эластина.

.jpg)


.jpg)




.jpg)