Около половины всех белков находится в организме человека гликопротеинов, Эти вещества играют роль компонентов клеток, а также иммунных веществ. В основном они образуются в результате так называемого N-гликозилирования и могут вызывать серьезные заболевания, если не собраны правильно.
Что такое гликопротеины?
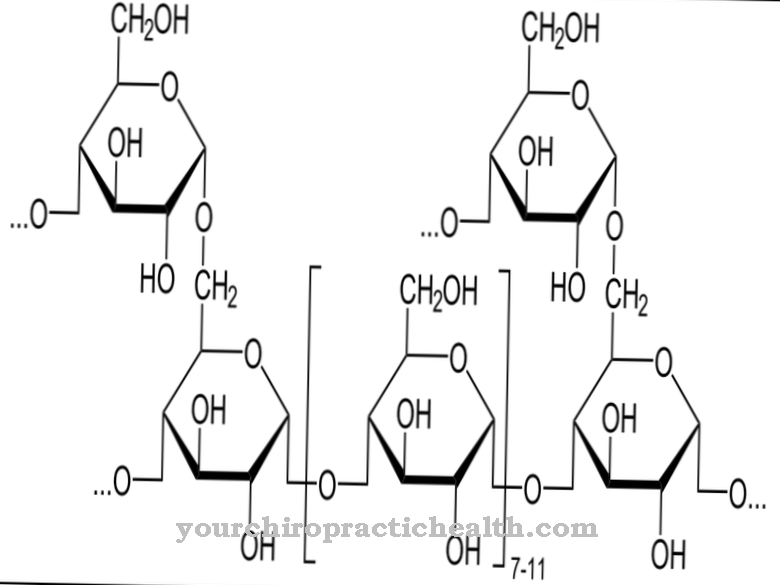
Гликопротеины - это белки с древовидными разветвленными остатками гетерогликанов. Обычно они имеют вязкую консистенцию. Макромолекулы содержат ковалентно связанные сахарные группы.
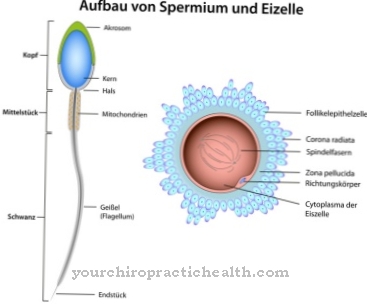
Они состоят из моносахаридов, таких как глюкоза, фруктоза, манноза или ацетилированный аминосахар. Вот почему они также известны как олигосахариды, связанные с белками. Ковалентная связь может иметь место по-разному и соответствует либо связи с аминокислотами серина, либо аспарагина. Связь с серином называется O-, а связь с N-гликозилированием аспарагина. Гликопротеины, участвующие в N-гликозилировании, различаются по размеру. Они соответствуют моносахаридам, ди- или олигосахаридам и даже полисахаридам.
По доле моносахаридов они делятся на высокоманнозные, сложные и гибридные гликопротеины. В группе, богатой маннозой, преобладают остатки маннозы. В сложной группе преобладают сахариды. Гибридная группа - это гибрид. Содержание углеводов в гликопротеинах составляет от нескольких процентов для рибонуклеаз до 85 процентов для антигенов группы крови.
Функция, эффект и задачи
Гликопротеины выполняют множество функций в организме человека. Они являются структурным компонентом клеточных мембран и в этом контексте также называются структурными белками. Они также содержатся в слизи и используются в качестве смазки в жидкостях.
Как мембранные белки, они участвуют во взаимодействии клеток. Некоторые гликопротеины также выполняют гормональные функции, например, фактор роста ХГЧ. Эти вещества так же важны, как и иммунологические компоненты в виде иммуноглобулинов и интерферонов. Все экспортные белки и мембранные белки организма по-прежнему были гликопротеинами, по крайней мере, во время биосинтеза. Они особенно важны для реакций распознавания в иммунной системе, поскольку взаимодействуют с иммунологическими Т-клетками и рецепторами Т-клеток. В плазме крови человека были выделены различные белки плазмы, из которых только альбумин и преальбумин не имеют остатков сахара.
Обилие гликопротеинов просто поражает. В конце концов, почти все внеклеточно растворимые белки и ферменты содержат остатки сахара. Как гормоны, гликопротеины обладают плейотропным действием и поэтому имеют решающее значение для деятельности различных систем органов. Гормоны TSH, HCG и FSH представляют собой, например, гликопротеины. Как мембранные белки они представлены как рецепторы, а также как переносчики и стабилизаторы. Они обладают стабилизирующим действием, особенно вместе с гликолипидами. Вместе с этими веществами они образуют так называемый гликокаликс, который стабилизирует клетки без клеточной стенки.
Образование, возникновение, свойства и оптимальные значения
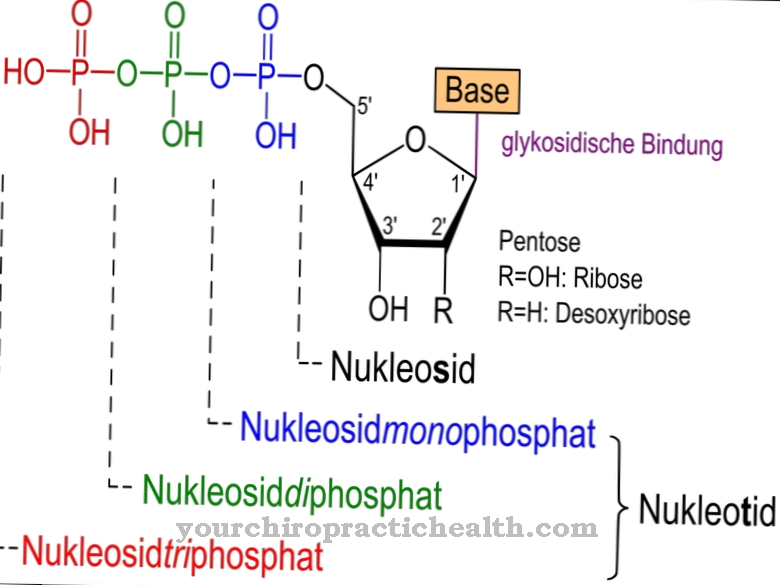
Наиболее частым образованием гликопротеинов является N-гликозидная связь или N-гликозилирование аспарагина. Сахар связывается с амидными группами, не содержащими азота. N-гликозилирование происходит в эндоплазматическом ретикулуме. Образованные таким образом N-гликозиды представляют собой наиболее подходящую группу гликопротеинов.
При N-гликозилировании предшественник сахара снимается с молекулы-носителя долихола, независимо от аминокислотной последовательности белка-мишени. Группа ОН на конце молекулы связана с дифосфатом. Предшественник олигосахарида образуется на концевом фосфатном остатке молекул. Первые семь сахаров собираются на цитозольной стороне. К долихолфосфату присоединены два N-ацетилглюкозамина и пять остатков манозы. В качестве доноров выступают сахарные нуклеотиды GDP-манноза и UDP-N-ацетил-глюкозамин. Предшественник транспортируется через мембрану ER через транспортный белок.
Таким образом, предшественник ориентирован внутрь эндоплазматического ретикулума, где к нему добавлены четыре остатка маннозы. Кроме того, растут остатки глюкозы. В конце концов, предшественник из 14 сахаров превращается в белок. Другой путь образования гликопротеинов - это О-гликозидная связь или О-гликозилирование серина, которое происходит в аппарате Гольджи клеток. Сахар связан с гидроксильной группой серина. Значения гликопротеинов особенно важны в отношении белков плазмы, поскольку они играют роль в общем анализе крови. Перечисление всех нормальных значений для гликопротеинов по отдельности на этом этапе выходит за рамки возможностей.
Заболевания и расстройства
Некоторые генетические заболевания влияют на гликозилирование. Одна группа таких заболеваний - CDG. Гликопротеины показывают ненормальные значения. Пострадавшие страдают от замедленного развития, что связано как с физическими, так и с психическими проблемами.
Косоглазие может быть еще одним признаком генетического заболевания. В формировании глокопротеинов участвуют около 250 различных генов. В случае врожденных нарушений гликозилирования нарушения прикрепления боковых углеводных цепей к белкам происходят из-за генетической предрасположенности. В посттрансляционной модификации белки получают полную функциональность. В этом процессе, когда ферменты или белки, которые создают боковые углеводные цепи, ненормально собираются вместе, создается CDG. На N-гликозилирование чаще всего влияют нарушения. На сегодняшний день обнаружено около 30 ферментных дефектов, влияющих на N-гликозилирование.
Генетические нарушения O-гликозилирования встречаются несколько реже. Они проявляются при нервно-мышечных мультисистемных заболеваниях, таких как синдром Уокера-Варбурга. Поскольку гликопротеины выполняют очень много функций в организме, клиническая картина характеризуется множеством симптомов. Врожденные нарушения гликозилирования могут затронуть все системы органов. Нарушения психомоторного развития - главный симптом. Неврологические отклонения также распространены. Нарушения свертывания крови или эндокринные нарушения также не редкость.





.jpg)




.jpg)