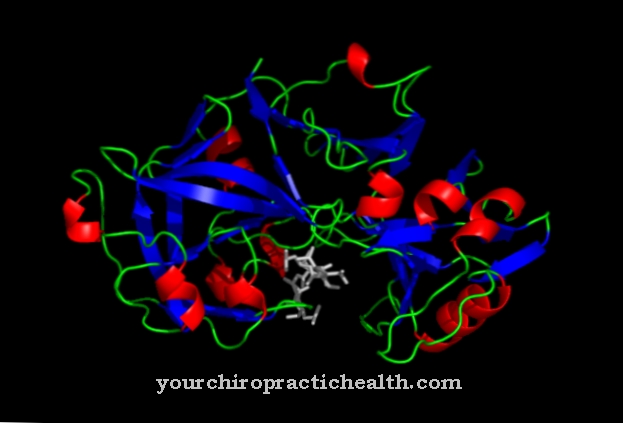
Лизил гидроксилазы представляют собой группу ферментов, которые отвечают за гидроксилирование остатков лизина в белках. Таким образом, они в основном вносят вклад в структуру соединительной ткани. Нарушения функции лизилгидроксилаз проявляются при таких заболеваниях, как цинга или наследственный синдром Элерса-Данлоса.
Что такое лизилгидроксилазы?
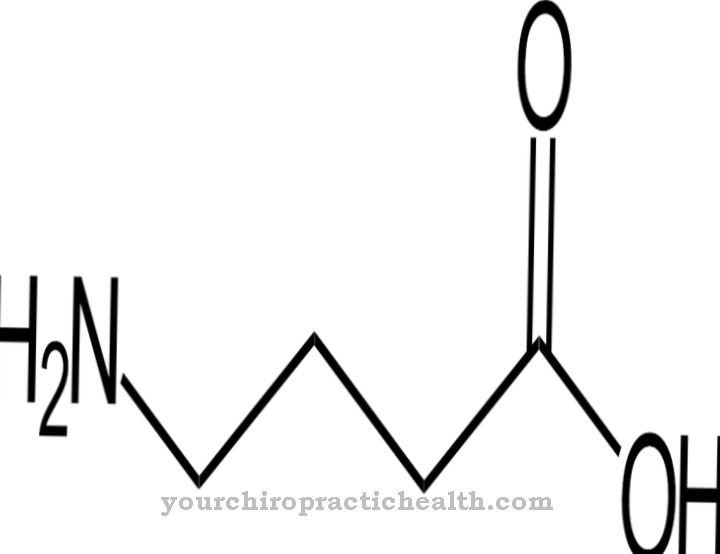
Лизилгидроксилазы - это ферменты, задача которых - катализировать посттрансляционную модификацию аминокислоты лизина путем включения гидроксильной группы в гидроксиллизин. Это укрепляет соединительную ткань, потому что ее белковые цепи получают возможность соединяться дальше через гидроксильные группы.
Лизилгидроксилаза человека состоит из 727 аминокислот. Лизилгидроксилазы также принадлежат к группе гидроксилаз, то есть ферментов, которые обычно катализируют включение гидроксильных групп в молекулы. Помимо лизилгидроксилаз, гидроксилазы или оксидоредуктазы также включают пролилгидроксилазы, фенилаланингидроксилазу, тирозингидроксилазу или триптофангидроксилазу. Лизилгидроксилазы, особенно вместе с пролилгидроксилазами, играют важную роль в функции соединительной ткани. Обе группы ферментов требуют для своей работы кофермент витамин С.
Функция, эффект и задачи
Функция лизилгидроксилаз состоит исключительно в том, чтобы катализировать включение гидроксильных групп в остатки лизина в белке. В ходе посттрансляционной модификации гидроксиламин аминокислоты образуется из лизина.
Хотя гидроксиламин также является свободным, он не может быть включен в белок в этой форме. Следовательно, посттрансляционная модификация означает последующее преобразование этой аминокислоты после того, как белок был построен. Когда атом водорода заменяется гидроксильной группой, в этот момент в белок встраивается функциональная группа, которая может выполнять мостиковые функции. С помощью гидроксильной группы различные белковые цепи могут соединяться вместе. Кроме того, с этой функциональной группой могут связываться молекулы сахара. Обе реакции очень важны, помимо прочего, в развитии соединительной ткани.
Соединительная ткань охватывает организм и внутренние органы. Он должен быть твердым и натянутым, чтобы можно было различать функционально разные органы. Это обеспечивается белками соединительной ткани, которые содержат высокий процент аминокислот лизина и пролина.Для этого обе аминокислоты впоследствии частично модифицируются после их включения в белок путем добавления гидроксильной группы. Как уже упоминалось, с пролином эта реакция катализируется пролилгидроксилазами, а с лизином - лизилгидроксилазами. После образования белка эти реакции модификации создают сеть белковых цепей, которые представляют собой плотную соединительную ткань.
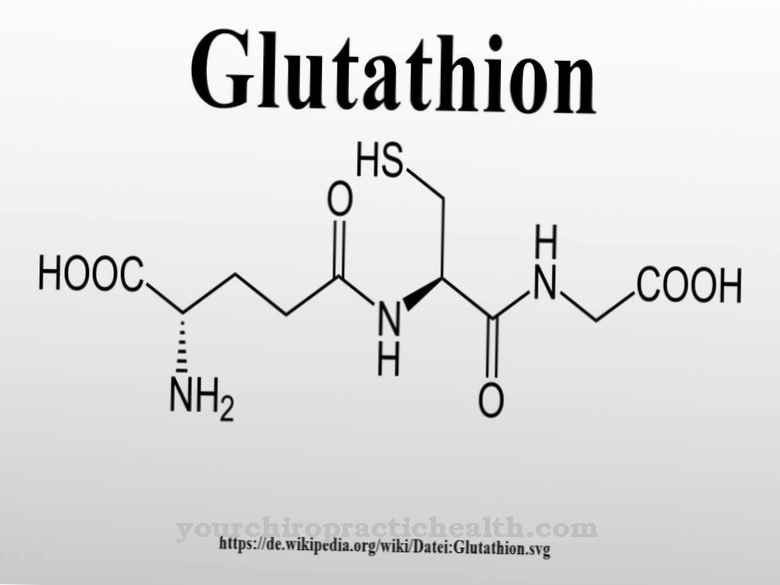
Без функции обоих ферментов развитие функциональной соединительной ткани было бы вообще невозможно. Однако оба фермента работают только с помощью кофермента аскорбиновой кислоты, то есть витамина С. Структурно измененные ферменты в результате мутации или недостатка витамина С могут привести к нарушениям в структуре соединительной ткани и, следовательно, к серьезным заболеваниям.
Образование, возникновение, свойства и оптимальные значения
Ген PLOD1 отвечает за кодирование лизилгидроксилазы человека. Название PLOD1 происходит от названия лизилгидроксилазы «проколлаген-лизин, 2-оксоглутарат-5-диоксигеназа 1». Этот ген расположен на хромосоме 1. Поскольку постоянно создается новая соединительная ткань, также существует постоянная потребность в производстве лизилгидроксилазы. Следовательно, мутация этого гена может иметь очень серьезные последствия для здоровья организма.
Заболевания и расстройства
Нарушения функции лизилгидроксилазы играют особенно важную роль при цинге и синдроме Элерса-Данлоса. Цинга - это древняя болезнь мореплавателей, причиной которой является недостаток витамина С. Витамин С, также известный как аскорбиновая кислота, действует как кофермент лизилгидроксилаз и пролилгидроксилаз. Если он отсутствует, аминокислоты лизин и пролин в белке соединительной ткани больше не могут быть гидроксилированы.
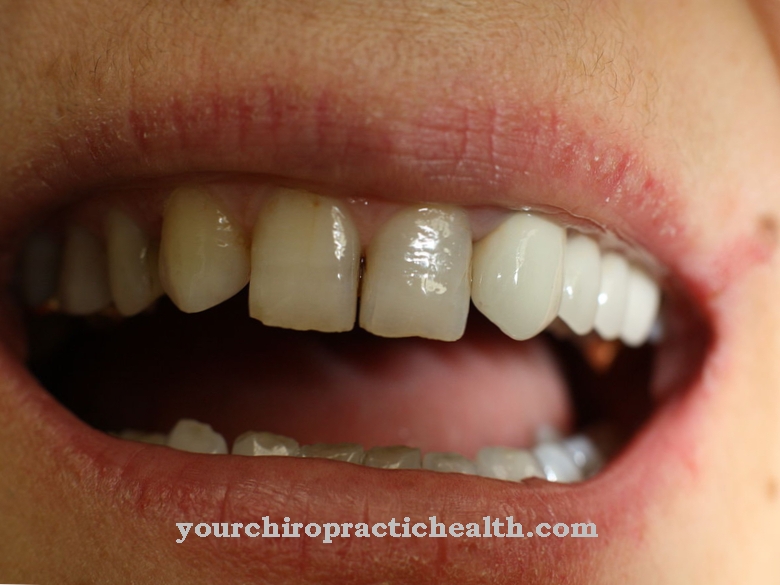
Поскольку происходит постоянное накопление и распад белков соединительной ткани, белковые цепи все менее и менее способны к взаимодействию в период авитаминоза. Соединительная ткань становится слабой и больше не может выполнять свою функцию должным образом. Возникает множество симптомов, включая общее истощение, восприимчивость к инфекциям, кровоточивость десен, потерю зубов, плохое заживление ран, серьезные кожные проблемы, мышечную атрофию и многие другие нарушения здоровья. В конечном итоге цинга может привести к смерти от сердечной недостаточности или тяжелых инфекций. Особенно пострадали древние мореплаватели, потому что они не могли получить достаточно витамина С во время длительных морских путешествий.
Было показано, что болезнь сразу же излечивается, когда ей дают определенные продукты, такие как квашеная капуста. Лишь позже было признано, что причиной болезни был дефицит витамина С. Вспышку болезни моряков цинги впоследствии удалось предотвратить, накормив моряков квашеной капустой. Еще одно заболевание, которое лишь частично можно объяснить дефектом лизилгидроксилазы человека, - это синдром Элерса-Данлоса. Синдром Элерса-Данлоса - это собирательный термин для различных наследственных заболеваний соединительной ткани с разными причинами. Этот синдром характеризуется сильной слабостью соединительной ткани.
Кожа легко растягивается, суставы подвижны. Генетически модифицированная лизилгидроксилаза вызывает синдром Элерса-Данлоса типа VI. За это отвечает мутировавший ген PLOD1, расположенный на хромосоме 1. Образовавшийся из этого дефектный фермент больше не функционирует полностью и может лишь в недостаточной степени катализировать реакции гидроксилирования лизина. Развивается слабая соединительная ткань с известными симптомами, а также с дополнительным поражением глаз и внутренних органов. Синдром Элерса-Данлоса VI типа может быть унаследован как аутосомно-рецессивный признак.





.jpg)




.jpg)