Дегидрогеназы - ферменты, участвующие в процессах окисления. Они встречаются в организме человека в различных вариантах и, например, катализируют распад алкоголя в печени.
Что такое дегидрогеназы?
Дегидрогеназы - это специализированные ферменты. Биокатализаторы ускоряют естественное окисление субстратов. Окисляющее вещество теряет электроны. В биологических реакциях дегидрогеназы отщепляют анионы водорода от субстрата. Анионы - это отрицательно заряженные частицы.
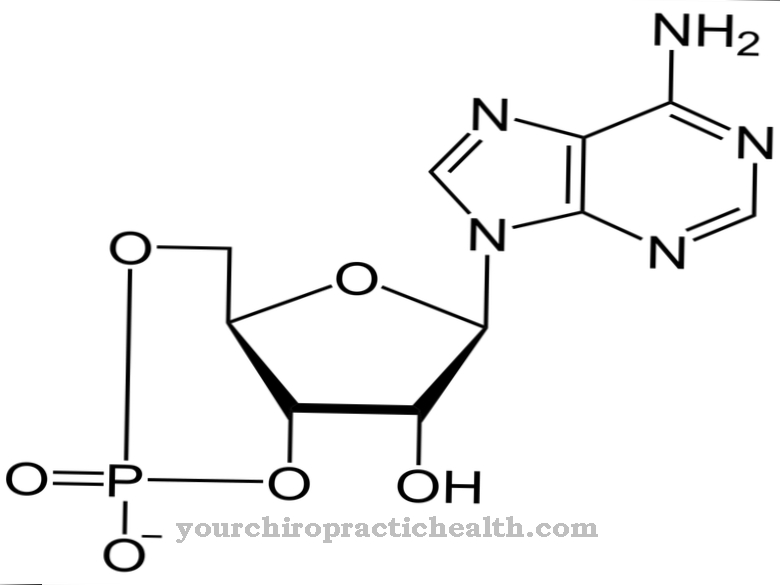
В этом случае атом водорода принимает электрон и тем самым получает отрицательный электрический заряд. Фактическая реакция происходит в активном центре фермента. Когда дегидрогеназа отщепляет водородный анион от субстрата, кофакторы захватывают электроны и водород. Кофакторы - это молекулы, которые играют вспомогательную роль в ферментативных процессах, но не участвуют в самом расщеплении. Кофакторы дегидрогеназ включают никотинамидадениндинуклеотид (NAD +) и флавинадениндинуклеотид (FAD).
В отличие от дегидрогеназ, дегидратазы отщепляют целые молекулы воды от своего субстрата. Дегидрогеназы также могут вызывать обратную реакцию и способствовать восстановлению, а не окислению. Во время восстановления частица принимает электроны, а не отдает их. Биология относит дегидрогеназы к оксидредуктазам. Эти типы ферментов существуют в каждом живом организме.
Функция, эффект и задачи
Дегидрогеназы - это группа, состоящая из множества специализированных ферментов. У отдельных ферментов разные задачи в организме человека. Биология делит различные дегидрогеназы на другие подгруппы.
Например, альдегиддегидрогеназы (ALDH) образуют группу дегидрогеназ, которые в основном обнаруживаются в печени. Как правило, ALDH отвечает только за определенный субстрат и не может способствовать окислению других субстратов. Например, ALDH1A1, -1A2 и -1A3 обрабатывают сетчатку, содержащуюся в витамине А. Однако есть исключения из этого правила: например, ALDH2 может работать с разными субстратами и не ограничивается одним веществом.
В печени дегидрогеназы расщепляют алкоголь, например этанол. Они помогают очищать кровь, что является одной из важнейших задач печени. Молекула этанола сначала стыкуется с активным центром алкогольгидрогеназы (ADH). С помощью фермента этанол окисляется, отщепляя отрицательно заряженный атом водорода и отдавая его своему кофактору НАД +: Таким образом, АДГ превращает этанол в ацетальдегид. Ацетальдегид, или этаналь, токсичен и вызывает ряд заболеваний.
Пища обычно содержит лишь небольшое количество этанола, который организм может быстро преобразовать. Поэтому количество этаналя невелико. Ацетальдегид, в свою очередь, является субстратом для ALDH. ALDH катализирует превращение ацетальдегида в уксусную кислоту до того, как уксусная кислота может быть далее расщеплена и расщеплена на воду и диоксид углерода. В таком виде молекулы совершенно безвредны.
Образование, возникновение, свойства и оптимальные значения
Дегидрогеназы в основном находятся в жидких частях клеточной плазмы или в митохондриях. Женские тела производят меньше АДГ, чем мужские. Это способствует тому, что женщины в среднем более чувствительны к алкоголю.
Точные значения различных дегидрогеназ различаются не только между разными группами ферментов, но также между разными людьми и этническими группами. В Восточной Азии и среди коренных народов Америки и Австралии уровни АДГ в среднем ниже, чем, например, у европейцев. В геноме человека есть 19 известных генов, определяющих ALDH. Эти гены находятся на двенадцатой хромосоме. Они определяют порядок расположения аминокислот в белковых цепях.
Из этой последовательности вытекают свойства белковых структур. Форма дегидрогеназ и, следовательно, их функция также зависят от последовательности аминокислот во время синтеза. Например, ALDH2 состоит из 500 аминокислот. Как правило, клетки синтезируют дегидрогеназы, которые им впоследствии также понадобятся; Это означает, что нет необходимости перевозить вещества.
Заболевания и расстройства
Когда алкоголь распадается в организме человека, на промежуточной стадии образуется ацетальдегид. Вещество ядовито; поэтому фермент ALDH должен как можно быстрее преобразовать его в уксусную кислоту. Однако с большим количеством алкоголя это обычно не работает полностью. Следовательно, похмелье сохраняется через несколько часов после употребления алкоголя.
Медицина также называет это Вейсалгией. Типичные симптомы - головная боль, недомогание, тошнота в желудке, рвота и потеря аппетита. Способность концентрироваться и реагировать часто ограничена. Насколько люди чувствительны к алкоголю, зависит, среди прочего, от того, сколько дегидрогеназ вырабатывают клетки печени. Дегидрогеназы также играют роль в развитии или поддержании различных заболеваний. Например, жирная альдегиддегидрогеназа (FALDH) играет центральную роль в развитии синдрома Шегрена.
Основные симптомы клинической картины - умственная отсталость и прогрессирующая спастическая параплегия. Спастическая параплегия - нейродегенеративное заболевание, характеризующееся спастическим параличом ног. Синдром Шегрена-Ларссона также означает, что роговой слой кожи более выражен и образует четко видимые чешуйки кожи (ихтиоз). Помимо этих трех основных симптомов, часто встречаются нарушения сетчатки. Причина синдрома кроется в генах, кодирующих FALDH. Из-за мутации организм неправильно синтезирует ферментный комплекс с FALDH. В результате повышается концентрация жирных спиртов и жирных альдегидов в плазме крови.




.jpg)




.jpg)