Лизилоксидаза представляет собой фермент соединительной ткани, который выполняет каталитические задачи и способствует сшиванию коллагена и эластина. Фермент оказывает стабилизирующее действие на соединительную ткань, выполняя окислительное дезаминирование и тем самым создавая основные условия для сшивания. У Cutis laxa снижена активность лизилоксидазы.
Что такое лизилоксидаза?
В организме человека есть разные ферменты, каждый из которых обладает каталитической активностью. Ферменты активируют реакции в организме человека или ускоряют их. Лизилоксидаза - это фермент, обнаруженный в соединительной ткани человека. Он также называется протеин-лизин-6-оксидазой и обнаруживается в основном во внеклеточном пространстве соединительной ткани.
Каталитическая активность фермента в этом случае связана с образованием поперечных связей между коллагеном и эластином. Лизилоксидаза механически стабилизирует два белка и, таким образом, обеспечивает реактивное соединение. Лизилоксидаза содержится не только в организме человека. Другие позвоночные также снабжены этим ферментом. Лизилоксидаза считается стабилизатором соединительной ткани. Дефицит фермента приводит к клинической картине кутислакса, тяжелой наследственной слабости соединительной ткани.
Функция, эффект и задачи
Лизилоксидаза берет на себя важные задачи во внеклеточном пространстве, создавая перекрестные связи между отдельными молекулами коллагена. В организме человека коллаген играет важную роль в составе белков, составляя около 30 процентов от общей массы белка.
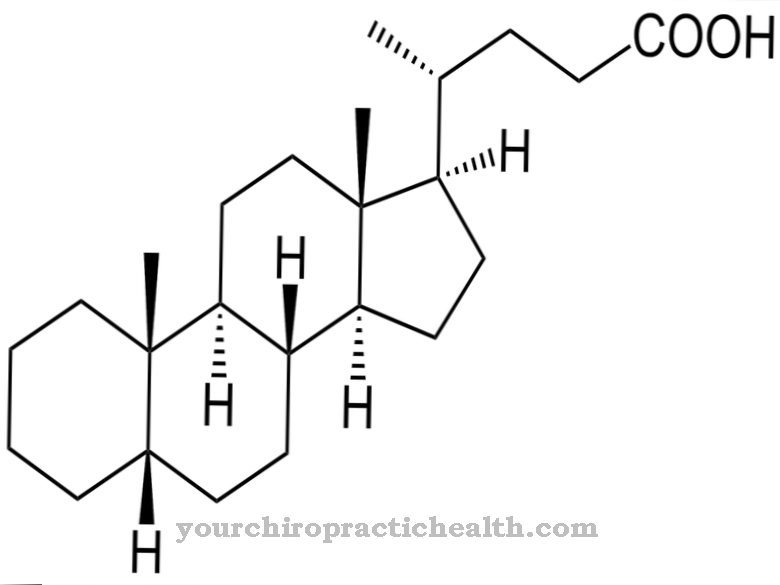
Коллаген - самый распространенный белок. Это структурный и строительный белок, из которого состоят многие части тела, такие как соединительная ткань, кости, зубы, хрящи, сухожилия, связки и кожа. Лизилоксидаза поддерживает связывание коллагена с карбонильными группами и, таким образом, способствует стабильности упомянутых компонентов организма. Он обладает каталитической активностью в отношении образования карбонильных групп, которые образуют ковалентные поперечные связи на коллагенах при альдольной конденсации. Таким образом, каталитическая задача лизилоксидазы - подготовиться к образованию фибрилл. Фермент создает все химические условия, необходимые для образования.
Фибриллы считаются волокнами волокна. Они соответствуют тонким и волокнистым частям тела и находятся в стенках клеток растений, в мышцах человека и в соединительной ткани. Задача лизилоксидазы в этом контексте заключается, по существу, в окислительном дезаминировании лизильных остатков. В химии дезаминирование - это химическое отщепление аминогрупп, таких как ионы аммония или аммиака. Окислительное дезаминирование отщепляет аминогруппы L-глутамата аминокислоты от водорода и окисляет их до иминогрупп с переносом водорода на NAD + или NADP +.
Затем следует гидролитическое расщепление иминогрупп в виде ионов аммония, что связано с образованием α-кетокислоты. Дезаминирование соответствует первому этапу биохимического распада аминокислот, который у млекопитающих в основном происходит в печени. Ион аммония, образующийся при дезаминировании, превращается в мочевину. Процессы дезаминирования лизилоксидазы приводят к образованию альдегидных групп, которые вместе с отдельными аминогруппами других лизильных остатков создают так называемые основания Шиффа и, таким образом, могут образовывать стабилизирующие поперечные связи в коллагене.
Образование, возникновение, свойства и оптимальные значения
Лизилоксидаза в ДНК кодируется геном LOX, который у человека расположен на хромосоме 5 в локусе гена q23.3 - q31.2. Продукт гена не является конечной формой фермента. Продукт не является готовой лизилоксидазой, а является предшествующей формой, которая после трансляции имеет молярную массу 47 кДа.
В дальнейшем происходит гликозилирование. Во время этого процесса молярная масса более позднего фермента увеличивается до 50 кДа, и предшествующая форма лизилоксидазы секретируется во внеклеточное пространство. После секреции пре-пролизилоксидаза подвергается дальнейшей обработке. Вещество расщепляется во внеклеточном пространстве. За расщепление на два фрагмента отвечает белок 1. Таким образом, с одной стороны, образуется лизилоксидаза 32 кДа. С другой стороны, создается остаточное вещество, которое в данном случае соответствует полипептиду.
Заболевания и расстройства
Генетические дефекты лизилоксидазы могут вызывать клиническую картину cutix laxe. Это заболевание также называется дерматохалазисом и относится к группе часто связанных с возрастом недостатков соединительной ткани, которые в большинстве случаев наблюдаются при семейном накоплении.
Общей характеристикой всех явлений дерматохалазиса является дряблая и неэластичная кожа, которая часто свисает большими складками на различных частях тела. Большинство пострадавших выглядят старше, чем они есть из-за изменений. Болезни вызваны, среди прочего, генетическими мутациями. В данном контексте речь идет о синдроме кутислакса. Заболевание может существовать в аутосомно-рецессивной, аутосомно-доминантной и х-хромосомной формах. Во многих случаях синдром кутислакса связан с другими аномалиями и, например, при поражении органов может быть фатальным.
ARCL1 соответствует кутис-лаксе аутосомно-рецессивного типа 1 и считается наиболее тяжелой формой, которая при определенных обстоятельствах может привести к опасным для жизни осложнениям. Форма ARCL1A связана с мутациями в гене FBLN5 в локусе 14q32.12. Тип ARCL1B связан с мутациями в гене EFEMP2 в локусе 11q13.1, а вариант ARCL1C соответствует кутис-лаксе с сопутствующими аномалиями в легких, желудочно-кишечном тракте и мочевыводящих путях, которые происходят из-за мутаций в гене LTBP4 в локусе 19q13.2.
Мутации в упомянутых генах приводят к активности ликсилоксидазы ниже средней. Неадекватные перекрестные связи создаются из-за пониженной активности фермента. Соединительная ткань пациента недостаточно стабилизирована.

.jpg)





.jpg)
.jpg)



.jpg)