миозин принадлежит к моторным белкам и, помимо прочего, отвечает за процессы сокращения мышц. Существуют различные типы миозинов, каждый из которых участвует в процессах транспорта клеточных органелл или в сдвигах внутри цитоскелета. Структурные отклонения в молекулярной структуре миозина могут при определенных обстоятельствах быть причиной мышечных заболеваний.
Что такое миозин?
Наряду с динеином и кинезином, миозин является одним из моторных белков, которые отвечают за процессы клеточного движения и транспортные процессы внутри клетки. В отличие от двух других моторных белков миозин работает только с актином. Актин, в свою очередь, является частью цитоскелета эукариотической клетки. Следовательно, он отвечает за структуру и стабильность клетки.
Кроме того, актин с миозином и двумя другими структурными белками образуют фактическую сократительную структурную единицу мышцы. Две трети сократительных белков в мышцах составляют миозины, а одна треть - актин. Однако миозины присутствуют не только в мышечных клетках, но и во всех других эукариотических клетках. Это относится как к одноклеточным эукариотам, так и к клеткам растений и животных. Микрофиламенты (актиновые филаменты) участвуют в структуре цитоскелета всех клеток и вместе с миозином контролируют протоплазматические токи.
Анатомия и строение
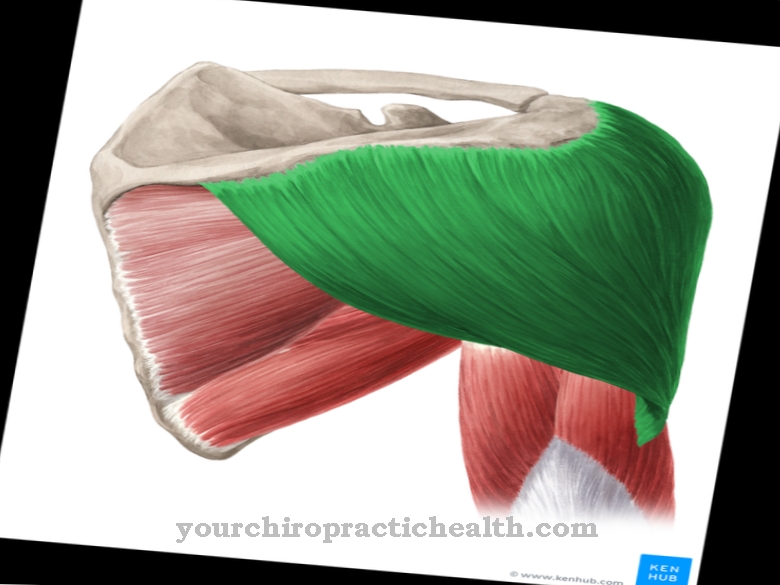
Миозины можно разделить на разные классы и подклассы. В настоящее время известно более 18 различных классов, из которых наиболее важными являются классы I, II и V. Миозин, обнаруженный в мышечном волокне, называется обычным миозином и относится к классу 2. Структура всех миозинов аналогична. Все они состоят из головной части (миозиновой головки), шейной и хвостовой части.
Миозиновые нити скелетных мышц состоят примерно из 200 молекул миозина II, каждая с молекулярной массой 500 кДа. Изголовье кровати генетически очень консервативно. Разделение на структурные классы в основном определяется генетической изменчивостью хвостовой части. Головная часть связывается с молекулой актина, а шейная часть действует как шарнир. Хвостовые части нескольких молекул миозина накапливаются и образуют нити (пучки). Молекула миозина II состоит из двух тяжелых и четырех легких цепей.
Две тяжелые цепи образуют так называемый димер. Более длинная из двух цепей имеет структуру альфа-спирали и состоит из 1300 аминокислот. Более короткая цепь состоит из 800 аминокислот и представляет собой так называемый моторный домен, он образует головную часть молекулы, которая отвечает за движения и транспортные процессы. Четыре легкие цепи соединены с головкой и шейкой тяжелых цепей. Легкие цепи, расположенные дальше от головы, называются регуляторными, а легкие цепи, расположенные ближе к голове, - существенными цепями. Они очень близки к кальцию и, таким образом, могут контролировать подвижность шейной части.
Функции и задачи
Наиболее важной функцией всех миозинов является транспортировка клеточных органелл в эукариотических клетках и выполнение сдвигов внутри цитоскелета. Обычные молекулы миозина II вместе с актином и белками тропомиозином и тропонином ответственны за сокращение мышц. Для этого миозин сначала интегрируется в Z-диски сакомера с помощью белка тайтина. Шесть нитей тайтина фиксируют миозиновую нить.
В сакомере миозиновая нить образует около 100 поперечных связей по бокам. В зависимости от структуры молекул миозина и содержания миоглобина можно выделить несколько форм мышечных волокон. Сокращение мышц происходит внутри сакомера из-за движения миозина в цикле поперечного моста. Прежде всего, головка миозина прочно прикреплена к молекуле актина. Затем АТФ расщепляется на АДФ, в результате чего высвобождаемая энергия приводит к напряжению миозиновой головки. В то же время легкие цепи обеспечивают увеличение ионов кальция. Это заставляет миозиновую головку прикрепляться к соседней молекуле актина в результате конформационного изменения.
При разрыве старого соединения напряжение теперь преобразуется в механическую энергию за счет так называемого силового удара. Движение похоже на взмах весла. Головка миозина наклоняется от 90 градусов до 40-50 градусов. Результат - движение мышц. Во время сокращения мышцы укорачивается только длина сакомера, тогда как длины актиновых и миозиновых нитей остаются прежними. Запаса АТФ в мышце хватает примерно на три секунды. Расщепляя глюкозу и жир, АДФ превращается обратно в АТФ, так что химическая энергия все еще может быть преобразована в механическую.
болезни
Структурные изменения миозина, вызванные мутациями, могут привести к мышечным заболеваниям. Примером такого заболевания является семейная гипертрофическая кардиомиопатия. Семейная гипертрофическая кардиомиопатия - это наследственное заболевание, передающееся по аутосомно-доминантному признаку. Заболевание характеризуется утолщением левого желудочка без дилатации.
С распространенностью 0,2 процента среди населения в целом, это относительно распространенное заболевание сердца. Это заболевание вызывается мутациями, которые приводят к структурным изменениям бетамиозина и альфатропомиозина. Это не одна, а несколько точечных мутаций белков, участвующих в структуре сакомера. Большинство мутаций находится на хромосоме 14. Патологически заболевание проявляется утолщением мускулов левого желудочка.
Такая асимметрия толщины сердечной мышцы может привести к жалобам со стороны сердечно-сосудистой системы с сердечной аритмией, одышкой, головокружением, потерей сознания и стенокардией. Хотя у многих пациентов сердечная недостаточность практически отсутствует, может развиваться прогрессирующая сердечная недостаточность.






.jpg)






.jpg)
.jpg)