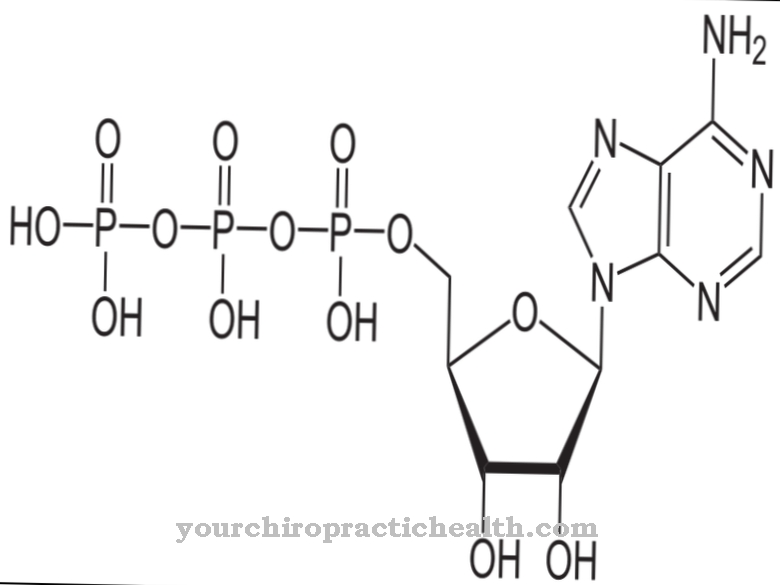
Гидроксилизин представляет собой неклассическую протеиногенную аминокислоту. Он включается в соответствующий белок в виде лизина и гидролизуется до гидроксилизина внутри полипептида с помощью фермента. Это один из основных компонентов белков коллагена в соединительной ткани.
Что такое гидроксилизин?
Гидроксилизин - это протеиногенная аминокислота, которая сначала включается в белок в виде лизина. Следовательно, это неканоническая протеиногенная аминокислота. Термин «канонический» означает классический.
Таким образом, для этой аминокислоты нет кодона. Гидроксилизин в основном содержится в коллагене соединительной ткани и гликопротеинах. Там лизин превращается в гидроксилизин посредством ферментативных процессов. Только часть лизина превращается в гидроксилизин. Свойства соответствующих коллагенов зависят от количества гидролизованных остатков лизина и пролина.
Гидроксилизин можно выделить в свободной форме в виде гидрохлорида. Гидрохлорид гидроксилизина представляет собой бежевый порошок с температурой плавления от 225 до 230 градусов. Это основная аминокислота, которая также заставляет гидроксилизин-содержащие белки реагировать основной. Гидроксилизин был открыт американским биохимиком и соучредителем «Клинической химии» Дональдом Ван Слайком (1883-1971).
Функция, эффект и задачи
Гидроксилизин имеет большое значение для структуры соединительной ткани. Гликопротеины также содержат гидроксилизин для образования гликозидных соединений белка с остатками сахара на гидроксильном остатке.
Внутри коллагена он отвечает за сшивание отдельных белковых молекул. Вместе с гидроксилпролином, гидролизованной формой пролина, он также играет важную роль в построении третичной и четвертичной структур коллагена. Гидроксилирование лизина катализируется ферментом лизилгидроксилазой с участием кофакторов ионов железа и аскорбиновой кислоты (витамина С). Картина распределения остатков гидроксилированного лизина в коллагене не является ни особенно жесткой, ни гибкой. Всегда есть повторяющиеся шаблоны.
Однако в белке также есть целые области, которые не содержат остатков гидроксилированного лизина. В то время как гидроксипролин отвечает за спиральную структуру коллагена за счет связывания трех белковых цепей, поперечные связи между различными белковыми молекулами образуются через гидроксильные группы гидроксилизина. Кроме того, эти молекулярные группы также служат сайтом связывания для гликозидной связи с сахаром. В целом это обеспечивает прочность соединительной ткани.
Если в белках отсутствует гидроксилизин, это не может быть исправлено дополнительным приемом аминокислоты. Для свободного гидроксилизина кодона отсутствует, поэтому он не может быть включен в соответствующий белок. Поэтому ценность пищевых добавок с добавлением гидроксилизина очень сомнительна. Следовательно, дефицит должен быть вызван недостаточным гидроксилированием лизина.
Образование, возникновение, свойства и оптимальные значения
Гидроксилизин содержится только в коллагене человека и животных. Есть также некоторые гликопротеины, которые также содержат гидроксилизин. Это включает адипонектин. Адипонектин - это гормон, который вырабатывается в жировой ткани и оказывает решающее влияние на эффективность инсулина. Гидроксилизин также был обнаружен у некоторых бактерий, таких как золотистый стафилококк.
Распределение гидроксилированного лизина в коллагене неоднородно. Есть места, где он почти всегда встречается. В других областях гидроксилизин практически не встречается. Это неравномерное распределение определяет структуру коллагена. В структуре тройной спирали коллагена гидроксилизин всегда находится в позиции Y повторяющейся последовательности Gly-X-Y. В коротких областях с неспиральной структурой гидроксилизин встречается и в других местах.
Заболевания и расстройства
Соединительная ткань полностью зависит от присутствия гидроксилизина. Коллаген может быть стабильным и твердым только в том случае, если работают поперечные связи между молекулами белка. Дефицит гидроксилизина вызывает слабость соединительной ткани.
Если он присутствует только в очень малых количествах или совсем не присутствует, соответствующий организм будет нежизнеспособным. Соединительная ткань больше не могла выполнять свою задачу как ограничивающая и поддерживающая ткань для органов. На самом деле, есть заболевания, которые могут быть связаны с недостатком гидроксилизина. Поскольку эта аминокислота изначально включается в виде лизина во время синтеза белка, она не может быть первичным дефицитом. Гидроксилизин образуется из лизина в белке коллагена с помощью лизилгидроксилаз. Дефицит гидроксилизина может быть результатом только дефекта этого фермента или его недостаточной функции.
Существует группа гетерогенных врожденных дефектов соединительной ткани, известная как синдром Элерса-Данлоса. За эту клиническую картину может быть ответственен ряд мутаций. Среди прочего, лизилгидроксилаза также может быть дефектной, так что слишком мало лизина гидроксилируется. Синдром Элерса-Данлоса проявляется чрезмерной растяжимостью кожи и повышенной подвижностью суставов. Также поражаются внутренние органы, кровеносные сосуды, сухожилия, связки и мышцы. Прогноз зависит от степени тяжести дефекта. Если задействованы суда, следует ожидать неблагоприятного курса. Полный отказ фермента лизилгидроксилазы несовместим с жизнью и поэтому не наблюдается.
Но даже при интактном ферменте соединительная ткань может быть слабой из-за ее низкой активности. Лизилгидроксилазе необходимы ионы железа и аскорбиновая кислота (витамин С) в качестве кофакторов. Если, например, не хватает витамина С, возникает так называемая цинга. Цинга - это приобретенное заболевание соединительной ткани, вызванное отсутствием гидроксильных групп на остатках пролина и лизина коллагена. Причина - низкая активность пролингидроксилазы и лизингидроксилазы из-за дефицита аскорбиновой кислоты.






.jpg)




.jpg)
.jpg)