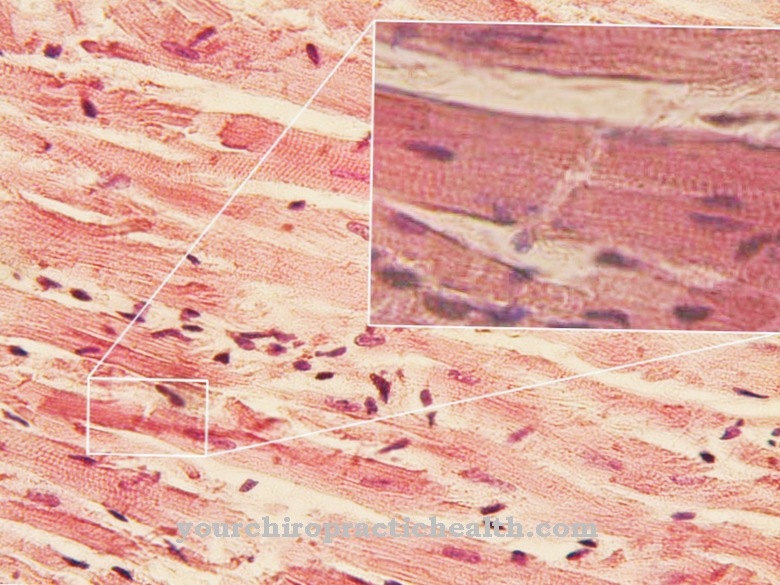
На Путь спасения новая биомолекула синтезируется из продуктов распада биомолекулы. Путь спасения также известен как путь восстановления и, так сказать, является формой повторного использования в метаболизме.
Каков путь спасения?
Путь спасения обозначает, с одной стороны, общую форму этого рециклирования в метаболизме, а с другой стороны, путь метаболизма пуриновых нуклеотидов. Пуриновые нуклеотиды являются основными химическими строительными блоками дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК).
При спасении путиновых нуклеотидов мононуклеотиды образуются из пуриновых оснований гуанина, аденина и гипоксантина. На 90% этот метаболический путь является основным метаболическим путем для свободных пуринов. Остальное расщепляется на мочевую кислоту. Путь спасения предлагает множество преимуществ, особенно по сравнению с биосинтезом пуриновых мононуклеотидов de novo. Например, он значительно более энергоэффективен.
Анатомия и строение
Синтез бициклических пуриновых оснований требует от организма больших усилий. Поэтому они разбиваются на простые основы, а затем используются снова.
В пути рециклинга различные промежуточные продукты распада мононуклеотидов, нуклеозидов, полинуклеотидов или оснований нуклеиновых кислот используются в построении реакций вместо их полного расщепления. Посредством реакции спасательного пути полезные и ценные промежуточные продукты метаболизма, так называемые метаболиты, могут быть спасены от утилизации. Таким образом, эти метаболиты не должны производиться снова. Этот процесс экономит высокое энергопотребление ячейки. В пути спасения рибозофосфат из фосфорибозилпирофосфата (PRPP) переносится на свободное пуриновое основание.
Нуклеотид образуется при отщеплении пирофосфата. Необходимые для этого ферменты активируются фосфорибозилпирофосфатом и ингибируются конечными продуктами. Из пуринового основания аденина образуется аденозинмонофосфат (AMP) вместе с (PRPP) и с помощью фермента аденинфосфорибозилтрансферазы (APRT). В связи с PRPP и ферментом гипоксантин-гуанин-фосфорибозилтрансферазой (HGPRT) гуанин становится нуклеотид-гуанозинмонофосфатом (GMP). С PRPP и ферментом гипоксантин-гуанин-фосфорибозилтрансферазой гипоксантин превращается в монофосфат нуклеотида инозина (IMP).
Другими ферментами, которые участвуют в пути спасения, являются нуклеозидфосфорилазы, нуклеозидкиназы и нуклеотидкиназы. 90% пуринов сначала превращаются в нуклеотиды, а затем снова используются для синтеза нуклеиновых кислот посредством превращений. 10% пуринов расщепляются на мочевую кислоту и выводятся через почки.
Функции и задачи
Путь спасения происходит почти во всех клетках тела, так как пурины расщепляются почти во всех клетках тела. Пурины принадлежат к группе гетероциклов и, наряду с пиримидинами, являются наиболее важными строительными блоками нуклеиновых кислот. Пурины образуются с использованием самого пути спасения. Они содержатся во всех клетках, имеющих ядро.
Пища животного происхождения, особенно субпродукты и кожа, содержат много пуринов. Пурины, которые не рециркулируются по пути спасения, расщепляются на мочевую кислоту и выводятся через почки. Для спасательного пути нет показателей крови, но есть для мочевой кислоты. У мужчин уровень мочевой кислоты в крови обычно составляет от 3,4 до 7,0 мг / 100 мл. У женщин число мочевой кислоты должно быть от 2,4 до 5,7 мг / л.
болезни
Если есть дефект в пути спасения, пурины больше не могут быть переработаны. Расщепляется значительно больше пуринов, поэтому образуется больше мочевой кислоты. Почки больше не могут полностью выводить мочевую кислоту, что приводит к гиперурикемии.
Гиперурикемия - это повышение уровня мочевой кислоты в крови. По определению, гиперурикемия возникает при уровне мочевой кислоты 6,5 мг / дл. Предельное значение одинаково применимо к обоим полам. Повышение уровня мочевой кислоты из-за нарушения пути восстановления также известно как первичная гиперурикемия. Около 1% всех гиперурикемий вызвано перепроизводством мочевой кислоты из-за нарушения метаболизма пуринов. Большинство случаев первичной гиперурикемии основано на снижении экскреции мочевой кислоты в почках.
Чтобы определить, является ли повышенный уровень мочи причиной снижения экскреции или увеличения выработки мочевой кислоты, необходимо определить клиренс мочевой кислоты. Для расчета клиренса мочевой кислоты определяют экскрецию мочевой кислоты в суточном сборе мочи и мочевую кислоту сыворотки.
В большинстве случаев гиперурикемия протекает бессимптомно. В случае массивной гиперурикемии возникает острый приступ подагры. Здесь в суставах откладываются кристаллизованные соли мочевой кислоты. Это приводит к воспалению пораженных суставов с перегревом, болью и сильным покраснением. Особенно часто поражаются плюснефаланговый сустав, голеностопный сустав и коленный сустав. Если подагра сохраняется длительное время, происходит реконструкция тканей. Хрящи в суставах утолщаются и развиваются так называемые подагрические тофусы.
Генетический дефект, приводящий к гиперурикемии, - это синдром Леша-Найхана. Заболевание наследуется рецессивным образом, сцепленным с Х-хромосомой, и приводит к дефициту фермента гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT). Поскольку фермент участвует в пуриновом метаболизме пуриновых оснований, гипоксантина и гуанина, для разложения образуется больше пуринов. В результате резко повышается уровень мочевой кислоты. Заболевание передается по Х-сцепленному типу. Вот почему синдром Леша-Найхана поражает почти исключительно мужчин. Первые симптомы появляются примерно через десять месяцев после родов.
Дети демонстрируют заметную стойку в сочетании с малоподвижным образом жизни и отклонениями в развитии. Первым признаком часто является повышенное содержание мочи в подгузнике. В тяжелых случаях также могут возникать самоповреждения, такие как укусы губ и пальцев, а также нарушение мышления. Пострадавшие дети могут также агрессивно вести себя по отношению к своим родителям, братьям и сестрам, друзьям или опекунам.





.jpg)




.jpg)



.jpg)
.jpg)